Ikatan Ion
Ditulis oleh Ratna dkk pada 15-04-20
Ikatan Ion
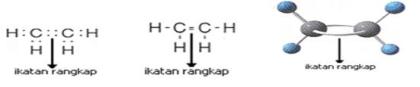
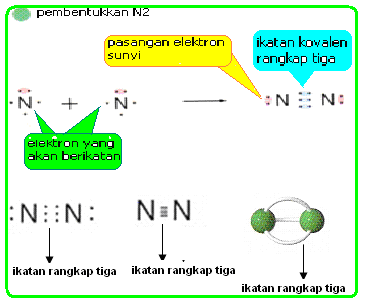
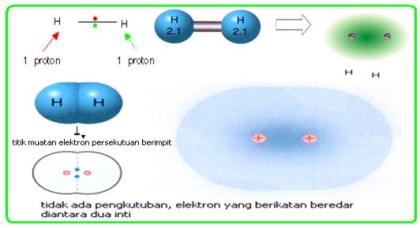
Ikatan ion adalah ikatan yang terbentuk akibat gaya tarik listrik (gaya Coulomb) antara ion yang berbeda. Ikatan ion juga dikenal sebagai ikatan elektrovalen.Pembentukan Ikatan Ion
Telah diketahui sebelumnya bahwa ikatan antara natrium dan klorin dalam narium klorida terjadi karena adanya serah terima elektron. Natrium merupakan logam dengan reaktivitas tinggi karena mudah melepas elektron dengan energi ionisasi rendah sedangkan klorin merupakan nonlogam dengan afinitas atau daya penagkapan elektron yang tinggi. Apabila terjadi reaksi antara natrium dan klorin maka atom klorin akan menarik satu elektron natrium. Akibatnya natrium menjadi ion positif dan klorin menjadi ion negatif. Adanya ion positif dan negatif memungkinkan terjadinya gaya tarik antara atom sehingga terbentuk natrium klorida. Pembentukan natrium klorida dapat digambarkan menggunakan penulisan Lewis sebagai berikut:
Pembentukan NaCl
Pembentukan NaCl dengan lambang Lewis
Susunan Senyawa Ion
Aturan oktet menjelaskan bahwa dalam pembentukan natrium klorida, natrium akan melepas satu elektron sedangkan klorin akan menangkap satu elektron. Sehingga terlihat bahwa satu atom klorin membutuhkan satu atom natrium. Dalam struktur senyawa ion natrium klorida, ion positif natrium (Na+) tidak hanya berikatan dengan satu ion negatif klorin (Cl-) tetapi satu ion Na+ dikelilingi oleh 6 ion Cl- demikian juga sebaliknya. Struktur tiga dimensi natrium klorida dapat digunakan untuk menjelaskan susunan senyawa ion.